近年来,基因修饰细胞治疗产品作为细胞与基因治疗(CGT)的代表推动了多种重大疾病治疗模式的变革。自CAR-T问世以来,基因修饰免疫细胞疗法展现出强大临床价值,也逐步显现出生产周期长、成本高、依赖专业设施等现实瓶颈。在此背景下,in vivo CAR-T应运而生,通过病毒或tLNP等递送方式在体内直接构建CAR-T细胞,不仅有望消除对复杂制备流程的依赖,大幅缩短交付时间,更被认为具备颠覆行业格局的潜力。随着干细胞类治疗和in vivo CAR-T等技术的快速推进,下一轮CGT领域的掘金热潮正加速到来。
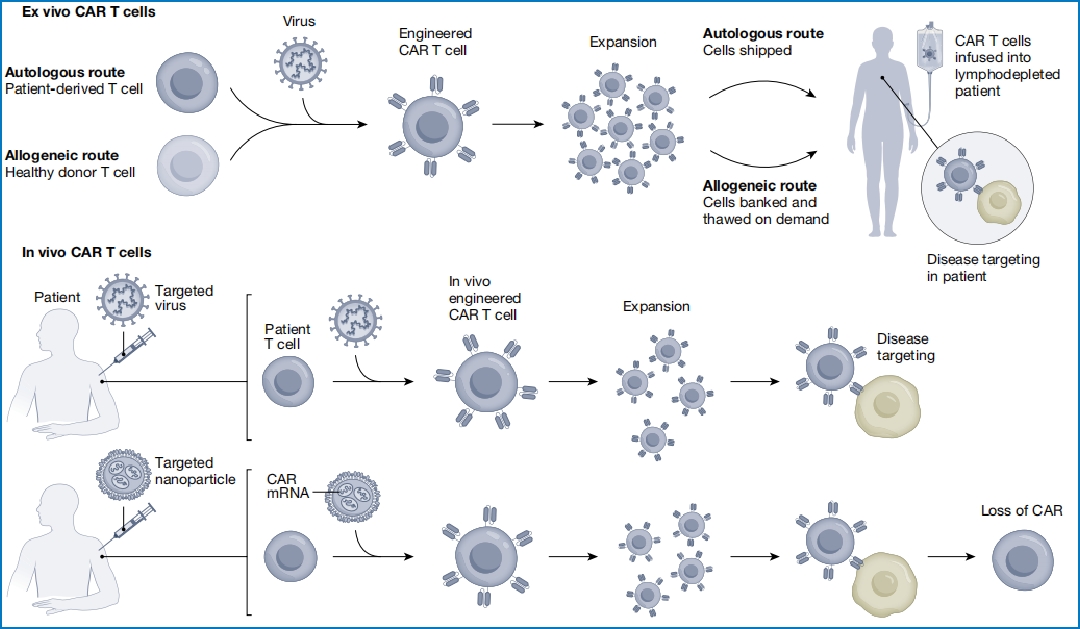
离体/体内CAR技术路线概览(Baker, Daniel J., et al. Nature 619.7971 (2023): 707-715.)
作为行业年度盛会,本次峰会汇聚1000余位细胞治疗与mRNA领域专家学者,聚焦体内CAR-T细胞治疗前沿赛道,围绕产业化突破、LNP与慢病毒技术选择,以及与UCAR-T、TCE等平台的差异化优势与协同潜力展开深入探讨。

报告现场
本次峰会,基锘威生物高级研发科学家韩伟博士分享主题演讲《新一代人源化模型在CAR-T治疗中的双重使命:安全性与药效评估》,并与各位专家共同探讨新一代全能人源化小鼠模型genO-BRGSF-HIS在细胞治疗安全性和药效评估中的应用前景。
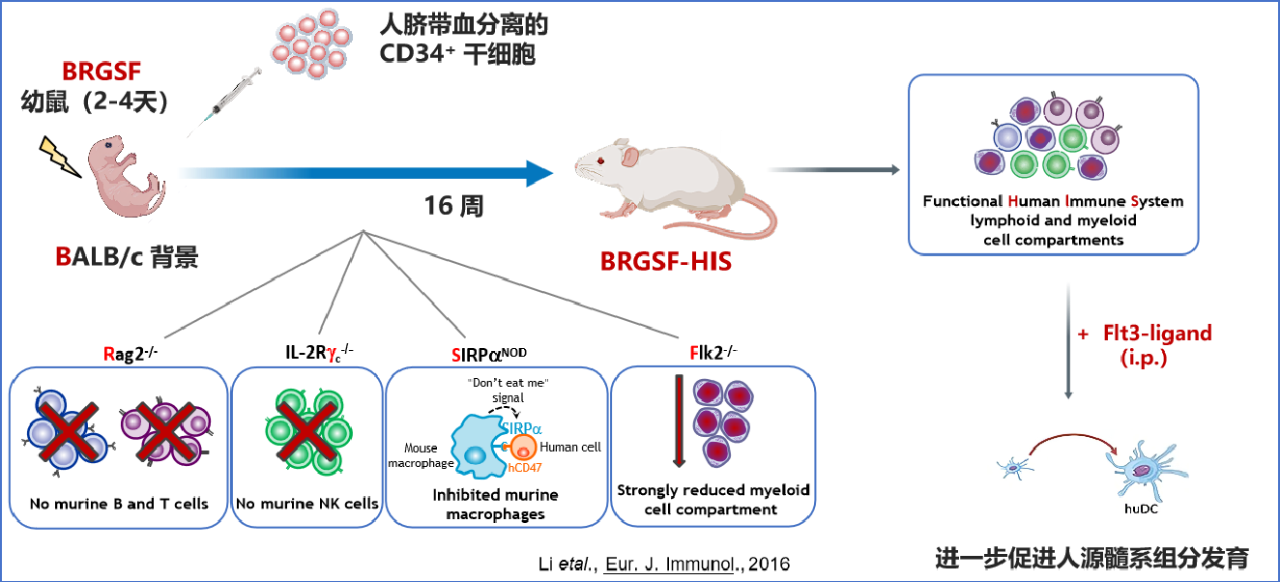
genO-BRGSF-HIS小鼠模型构建流程
hFlt3L注射后的第2天,单核细胞、cDC和pDC数量增加,随后逐渐恢复至基线水平。进一步测试明确hFlt3L的第二轮处理同样可诱导多种髓系细胞数量的增加,cDC和pDC的数量分别增加了19倍和21倍。此外,genO-BRGSF-HIS小鼠外周血中可检测到了NK细胞,并在hFlt3L刺激后进一步上升。
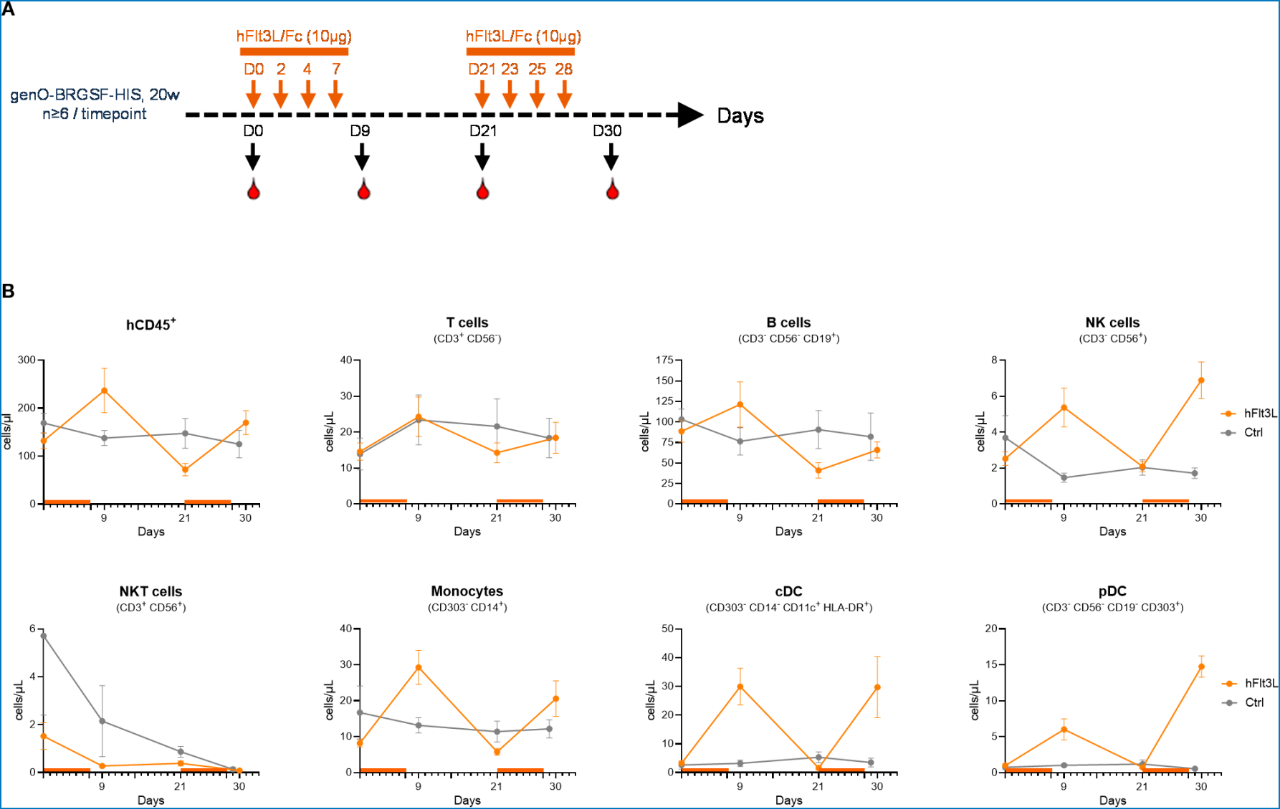
genO-BRGSF-HIS (+Flt3L)小鼠可重建出几乎所有人源免疫细胞,尤其是人源T和B细胞长效存续,是体内CAR-T功能验证及疗效评估的理想的动物模型。
在另一项实验研究中,通过OKT3对genO-BRGSF-HIS (+Flt3L)小鼠进行诱导刺激,在之后的6h,24h,48h进行各细胞因子分泌量检测。
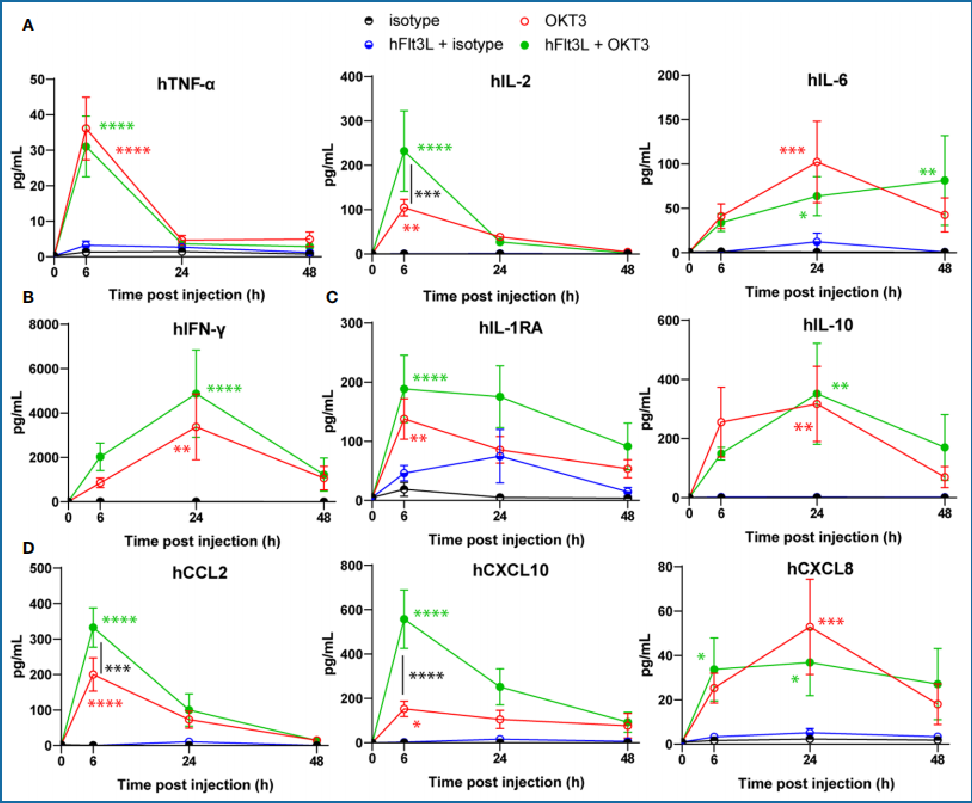
实验结果表明:
在OKT3处理后,TNF-α和IL-2水平于6小时达到峰值,与OKT3激活初始T细胞的作用机制一致。
Flt3L预处理显著增强OKT3诱导的人源细胞因子分泌,特别增加IL-1RA、CCL2、CXCL10的释放。
随后IL-6、IL-10和CXCL8水平进一步上升,反映髓系细胞被持续激活并推动炎症反应发展。
这表明BRGSF-HIS模型能较好模拟T细胞激活与髓系放大共同驱动的CRS机制,该模型可为多种疗法药物的临床前安全性评估提供保障。

END